Introdução
A artrite psoriática (APs) é uma condição heterogênea, envolvendo múltiplos tecidos e domínios clínicos, associada a uma alta carga de doença e comorbidades significativas.
A avaliação de pacientes com AP requer consideração de todos os domínios da doença, incluindo artrite periférica, doença axial, entesite, dactilite, psoríase cutânea, doença ungueal psoriásica, uveíte e DII.
O impacto da doença na dor, função, qualidade de vida e danos estruturais deve ser examinado.
A inflamação persistente pode levar à destruição e incapacidade, evitadas com diagnóstico e tratamento precoce.
Esses pacientes têm maior risco de desenvolver inflamação extra-músculo-esquelética e comorbidades, como doença inflamatória intestinal, uveíte, depressão, doença cardiovascular e síndrome metabólica.
1 em cada 4 pacientes com psoríase cutânea terão artrite psoriásica (alguns estudos falam em até 30%), especialmente aqueles com psoríase grave ou envolvimento de unhas/couro cabeludo.
Nos EUA incidência estimada de 8,5 por 100.000 habitantes com prevalência de 181,8 por 100.000 habitantes. Prevalência global 133 por 100,000 habitantes. Já no Brasil, em estudos de pacientes do SUS foi encontrado uma taxa de 24.4 casos por 100,000 habitantes.
Em proporção de sexo, costuma ser 1:1, sendo os casos de artrite psoriásica periférica mais comum em pacientes do sexo feminino, enquanto a doença axial é mais comum em pacientes do sexo masculino. As mulheres têm menos progressão radiográfica do que os pacientes do sexo masculino, mas piores resultados em dor, função e fadiga.
A apresentação da AP geralmente ocorre em pessoas de meia idade (até 25% pode ser tardio).
Manifestação clínica
O curso clínico da APs é bastante variável. Descobriu-se que o atraso no diagnóstico está associado a piores resultados a longo prazo. Aqueles com um atraso de 6 meses no diagnóstico após o início dos sintomas tiveram mais erosões articulares periféricas e piores pontuações no Health Assessment Questionnaire (HAQ).
A maioria dos pacientes desenvolve AP após o início da psoríase cutânea. A prevalência de AP não diagnosticada em pacientes com psoríase atendidos em clínicas de dermatologia é de cerca de 15%.
Moll e Wright descreveram cinco subtipos clínicos de artrite psoriática que destacam a heterogeneidade da doença.
O subtipo oligoarticular afeta quatro ou menos articulações e normalmente ocorre em distribuição assimétrica.
O subtipo poliarticular afeta cinco ou mais articulações; o envolvimento pode ser simétrico e assemelhar-se à artrite reumatóide.
O subtipo distal, que afeta as articulações interfalângicas distais das mãos, pés ou ambos, geralmente ocorre com outros subtipos, ocorrendo sozinho em apenas 5% dos pacientes.
A artrite mutilante, um subtipo deformador e destrutivo de artrite que envolve reabsorção óssea acentuada ou osteólise, é caracterizada por dedos telescópicos e instáveis.
Envolvimento inflamatório das estruturas articulares periféricas com sinovite é a manifestação mais comum da AP estabelecida. Geralmente é assimétrico e oligoarticular no início e com a progressão torna-se poliarticular, mais simétrico e pode se assemelhar à poliartrite de artrite reumatóide.
O subtipo axial ou espondiloartrite envolve principalmente a coluna vertebral e as articulações sacroilíacas. Estima-se que apenas 2–5% dos pacientes com AP apresentam doença axial isolada, enquanto 25–70% dos pacientes com AP de longa duração apresentam doença axial.
A entesite é observada em 30 a 50% dos pacientes e envolve mais comumente a fáscia plantar e o tendão de Aquiles, mas pode causar dor ao redor da patela, crista ilíaca, epicôndilos e inserções supraespinhais.
A dactilite é relatada em 40 a 50% dos pacientes e é mais prevalente no terceiro e quarto dedos do pé. A dactilite pode ser aguda (inchaço, vermelhidão da pele e dor) ou crônica (inchaço sem inflamação). A dactilite está frequentemente associada a doença grave caracterizada por poliartrite, erosão óssea e neoformação óssea.
Os principais sinais de psoríase no aparelho ungueal são pitting, onicólise e manchas de óleo. O pitting ou “unha em dedal” é mais comum nas unhas das mãos e caracteriza-se por depressões puntiformes na superfície da placa ungueal, resultantes do envolvimento da matriz unguea. A onicólise revela descolamento do leito ungueal na sua parte distal e a mancha de óleo ou mancha salmão é uma alteração da cor do leito ungueal que se torna visível devido à transparência da placa unguea. Entretanto, outros padrões de lesões ungueais também são descritos em psoríase, como hiperceratose subungueal, hemorragia em estilhaços (devido à rotura de capilares localizados no leito ungueal), eritema da lúnula, leuconíquia, sulcos de Beau, paroníquia, pústulas subungueais (na psoríase pustulosa e na acrodermatite de Hallopeau) e até onicomadese, que é o desprendimento de toda a unha. A psoríase ungueal piora com microtraumas (fenômeno de Koebner), sobretudo na mão dominante.
A característica clínica do envolvimento ungueal permite pressupor qual a região anatômica do aparelho ungueal está acometida:
Acometimento da matriz: pitting, leuconiquia, sulcos de Beau, manchas eritematosas na lúnula e onicomadese.
Acometimento do leito ungueal: manchas de óleo, onicólise distal, hemorragia em estilhaço subungueal e hiperceratose subungueal.
Manifestações extra musculoesqueléticas como: uveíte, doença inflamatória intestinal, psoríase cutânea, cardiovascular ( Insuficiência aórtica, aterosclerose acelerada, bloqueios de condução), urogenital (uretrite, prostatite, balanite, vaginite
e nefropatia por IgA, amiloidose).
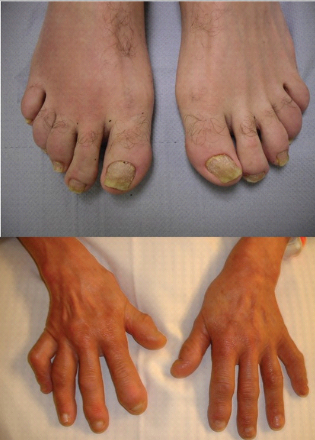
Exame Físico
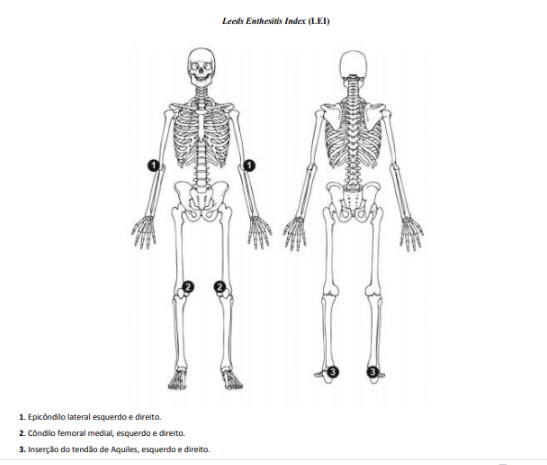
- Enteses
As enteses podem ser avaliadas usando o Leeds Enthesitis Index (LEI) ou o Spondyloarthritis Research Consortium Canada (SPARCC).

2.Dactilite
A dactilite pode ser avaliada pelo Leeds Dactylitis Index que leva em consideração a circunferência do dedo.
O dactilômetro mede a circunferência dos dedos inchados na base do dedo. Isso fornece uma definição quantificável de dactilite – um aumento na circunferência de > 10% a mais que o dígito contralateral. O LDI como medida combina esse nível de inchaço usando a medida da circunferência com uma pontuação (0-3 ou 0/1) para sensibilidade
3.Cutânea
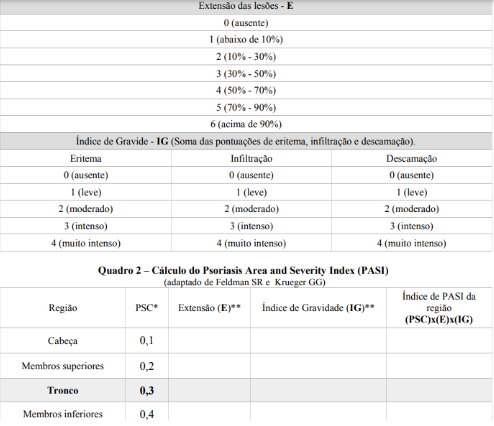
A psoríase cutânea pode ser avaliada com base na área de superfície corporal envolvida ou no Índice de Área e Gravidade da Psoríase (PASI).
Medidas mais simples concentraram-se apenas na medição da área de superfície corporal ou utilizaram avaliações mais simples da atividade geral da doença, como a Avaliação Global Médica Estática (sPGA). Isto pode ser registado numa escala de 1 (claro) a 6 (muito grave), mas avalia a qualidade da placa sem avaliar a área de superfície corporal. Mais recentemente, foram realizados trabalhos procurando uma combinação dos dois – sPGA × BSA para permitir uma medida simples e viável que abrange tanto a área de superfície corporal como uma caracterização da placa de psoríase.
Existe também o Índice de Qualidade de Vida em Dermatologia (DLQI)
– PASI
É um composto de área de superfície corporal (ASC), eritema, endurecimento e descamação da psoríase em diferentes áreas do corpo. o corpo (cabeça, tronco, membros superiores, membros inferiores)
DLQI

4.Ungueal
Para avaliação da unha pode ser usado o Índice de Gravidade de Psoríase Ungueal (NAPSI).
| A unha é dividida por linhas horizontais e longitudinais imaginárias em quadrantes. Cada unha recebe uma pontuação para psoríase do leito ungueal (0-4) e psoríase da matriz ungueal (0-4), dependendo da presença de qualquer uma das características da psoríase ungueal nesse quadrante. |
| A.Avaliação 1: Matriz ungueal. Em cada quadrante da unha, a psoríase da matriz ungueal é avaliada pela presença de qualquer uma das características da matriz ungueal (corrosão, manchas vermelhas de leuconíquia na lúnula, desintegração): 0 para nenhuma, 1 se presente em 1 quadrante da unha, 2 se presente em 2 quadrantes da unha, 3 se estiver presente em 3 quadrantes da unha e 4 se estiver presente em 4 quadrantes da unha. |
| B.Avaliação 2: Leito ungueal. A psoríase do leito ungueal é avaliada pela presença de qualquer uma das características do leito ungueal (onicólise, hemorragias em estilhaços, hiperqueratose subungueal, “gota de óleo” (discroma da mancha de salmão): 0 para nenhum, 1 para apenas 1 quadrante, 2 para 2 quadrantes, 3 para 3 quadrantes e 4 para 4 quadrantes. |
| C.Cada unha recebe uma pontuação de matriz e uma pontuação de leito ungueal, cujo total é a pontuação daquela unha (0-8). |
| D.Cada unha é avaliada e a soma de todas as unhas é a pontuação total do NAPSI. A soma das pontuações de todos os pregos é de 0 a 80; ou 0-160 se as unhas dos pés estiverem incluídas. A qualquer momento, a pontuação da matriz ou do leito ungueal pode ser avaliada de forma independente, se desejado.
|
5.Acometimento periférico
Índice de Atividade de Doença para Artrite Psoriática (DAPSA)
Contagem de articulações dolorosas (0-68)
Contagem de articulações edemaciadas (0-66)
Nível de PCR (mg/dl)
Atividade de doença (0 a 10)
Dor articular ( 0 a 10 )
Resultado = soma dos valores
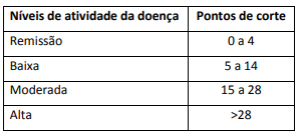
Demonstrou-se que os estados de atividade da doença DAPSA se correlacionam com o estado funcional e a progressão estrutural nas radiografias, fornecendo mais evidências de sua validade.
Outra métrica utilizada é escore de atividade da doença (DAS) emprestada da artrite reumatoide.
6. Axial
Ankylosing Spondylitis Disease Activity Score (ASDAS) – Avaliação Axial
Perguntas (nota de 0 -ausência de sintomas- a 10 -sintoma máximo- )
Dor lombar: quanto de dor na coluna você tem devido a espondilite ?
Avaliação global paciente: quanto ativa estava sua espondilite em média na ultima semana?
Articulação periférica: como você descreve de maneira geral a dor/edema em articulações outras que não o pescoço/lombar/quadril
Duração rigidez matinal (1 hora vale 5, 2 horas vale 10): quanto tempo dura sua rigidez na coluna desde que você acorda?
Valor do PCR (mg/l) ou VHS
Inativa se menor que 1,3; moderada 1,3 a 2,0; alta 2,1 a 3,5 e multo alta se maior que 3,5.
7.Medidas Compostas de Atividade de Doença
Dado que a AP é tão heterogênea, com envolvimento de múltiplos domínios em cada paciente, foram desenvolvidas várias medidas compostas da doença psoriásica para medir a carga global da doença.
- Composite Psoriatic Disease Activity Index (CPDAI)
A primeira medida composta verdadeira da atividade da doença na APs foi o Índice Composto de Atividade da Doença Psoriática (CPDAI).
Cada domínio da AP (articulações periféricas, pele, enteses, dactilite e doença axial) é avaliado usando uma medida da atividade da doença e uma medida do impacto da doença, e estas são somadas para criar uma pontuação total de 0-15.
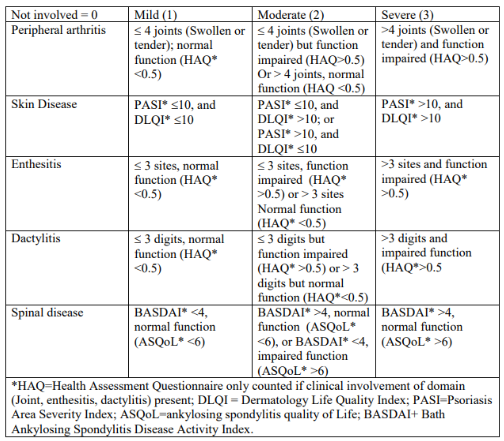
– GRACE
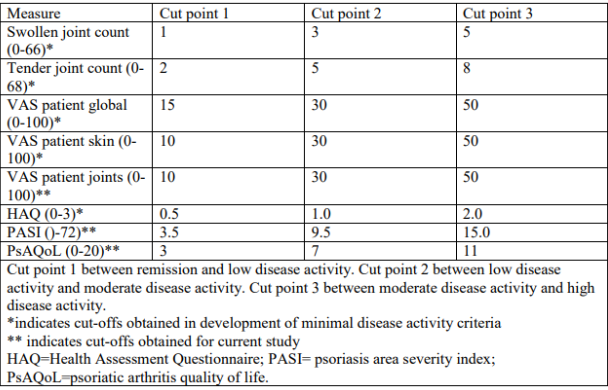
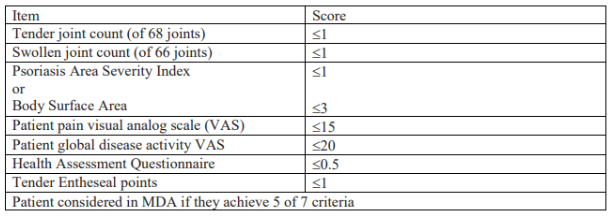
- Minimal Disease Activity (MDA) criteria
Os critérios de atividade mínima da doença (MDA) abrangem sete itens diferentes que são avaliados individualmente. Os critérios afirmam que os pacientes estão em MDA se atingirem cinco dos sete critérios: contagem de articulações dolorosas ≤ 1, contagem de articulações inchadas ≤ 1, contagem de entesite ≤ 1, PASI ≤ 1 ou BSA ≤ 3, pontuação visual analógica global do paciente (VAS) ≤ 20 mm, dor do paciente VAS ≤ 15 mm e questionário de avaliação de saúde (HAQ) ≤ 0,5.
A vantagem destes critérios é que avaliam múltiplos domínios da doença, a fim de estabelecer o controlo da doença; no entanto, avalie-os individualmente em vez de combiná-los numa única pontuação. Foi demonstrado que os critérios MDA estão associados a uma menor progressão radiográfica e ao impacto da doença no paciente bem como melhoria da qualidade de vida, capacidade funcional e estabilidade no trabalho.
Eles foram recomendados como alvo de terapia na AP pela força-tarefa internacional Treat-to-Target e pelo grupo GRAPPA-OMERACT.
A principal limitação dos critérios MDA é que eles apenas definem um estado de doença e não permitem a avaliação de diferentes níveis de atividade da doença.
8.Questionário de Avaliação de Saúde HAQ-DI
A pontuação final do HAQ-DI varia do melhor estado funcional (valor 0) ao pior (valor 3).
O HAQ-DI inclui 20 questões que cobrem avaliações de movimentos finos das extremidades superiores, atividades locomotoras das extremidades inferiores e atividades envolvendo as extremidades superiores e inferiors
Esses itens se enquadram em oito domínios: vestir-se, levantar-se, comer, caminhar, higiene, alcançar, agarrar e atividades habituais.
Cálculo final é feito pela média da pontuação de cada categoria.
9.Perspectiva do paciente – Medidas de resultados Relatados pelo Pacientes (PROMs)
Para captar o impacto total da doença psoriática no bem-estar físico e psicológico de um indivíduo, tem havido uma mudança de paradigma nos últimos anos no sentido da utilização de medidas de resultados que abrangem resultados da vida real importantes para os pacientes, juntamente com as métricas validadas já mencionada.
O questionário do Impacto da Doença da Artrite Psoriática (PsAID) tem como objetivo refletir o impacto da AP na perspectiva do paciente. Abrange 12 domínios, que abordam aspectos físicos e psicológicos da doença psoriática, como trabalho, fadiga e função física. Cada domínio é avaliado por uma única pergunta com resposta do paciente em uma escala numérica de 0 a 10, com resultados mais altos indicando uma condição mais grave. Cada domínio carrega um peso diferente, sendo que a dor tem o maior efeito. O valor de corte para um estado de sintomas aceitável pelo paciente é ≤ 4 para ambas as pontuações
São derivadas diretamente dos pacientes e foram consideradas indicadores confiáveis do estado da doença e preditores de resultados em longo prazo
As métricas mais amplamente aceitas que foram validadas para APs devem ser utilizadas sempre que possível.
Em ensaios clínicos, as medidas de resultados adaptadas de instrumentos utilizados para avaliar os resultados da artrite reumatóide incluem as taxas de resposta do American College of Rheumatology (ACR) 20, ACR 50 e ACR 70 (indicando reduções no número de articulações sensíveis e inchadas de pelo menos 20%, 50% e 70%, respectivamente, com melhora em pelo menos três das cinco medidas adicionais a seguir: avaliações globais do paciente e do médico, dor, incapacidade e um reagente de fase aguda.
As comorbilidades e condições relacionadas devem ser consideradas e o seu impacto na abordagem da doença e no seu tratamento deve ser abordado de forma adequada.
Tais condições incluem obesidade, síndrome metabólica, doença cardiovascular, depressão e ansiedade, doença hepática (por exemplo, doença hepática gordurosa não alcoólica), infecções crônicas, malignidade, saúde óssea (por exemplo, osteoporose), sensibilização central (por exemplo, fibromialgia). ) e saúde reprodutiva.
A avaliação e o manejo multidisciplinar e multiespecializado podem ser mais benéficos para pacientes individuais.
Laboratório e Imagem
Os testes para fator reumatóide, anticorpos antipeptídeo citrulinado cíclico ou ambos são negativos em 95% dos pacientes com artrite psoriática. Quando o resultado do teste é positivo, características clínicas e de imagem devem ser usadas para diferenciar a artrite psoriática da reumatóide.
Aproximadamente 25% dos pacientes com artrite psoriática são positivos para HLA-B27.
Aumento dos níveis sérico de proteína C reativa e velocidade de hemossedimentação podem não estar presente em todos os pacientes.
A ocorrência de destruição óssea e cartilaginosa com formação patológica de novo osso é um dos aspectos mais distintivos da artrite psoriátic.
As radiografias das articulações periféricas muitas vezes mostram evidências de perda óssea com erosões excêntricas e estreitamento do espaço articular, bem como nova formação óssea caracterizada por periostite, anquilose óssea e entesófitos (projeções ósseas anormais na inserção de um tendão ou ligamento).
No esqueleto axial, as alterações associadas à artrite psoriática incluem sacroileíte unilateral e sindesmófitos paramarginais e verticais volumosos.
A ultrassonografia Power Doppler pode ser usada para identificar sinovite, aumento do fluxo sanguíneo, tenossinovite, entesófitos e doença erosiva precoce.
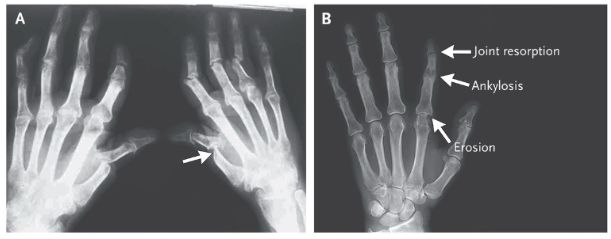
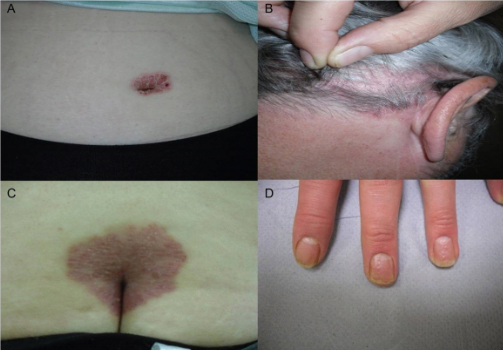
Fígura A mostrando uma artrite mutilantes (sinal em ponta de lápis) e reabsorção acentuada.
Fígura B mostra reaborsção articular, anquilose e erosão em um único dedo.
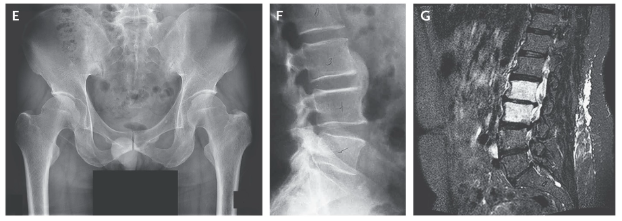
Fígura E mostra sacroileíte bilaterau grau 3
Fígura F mostra um sindesmófito em ponte
Fígura G mostra edema medular ósseo em L2 e L3
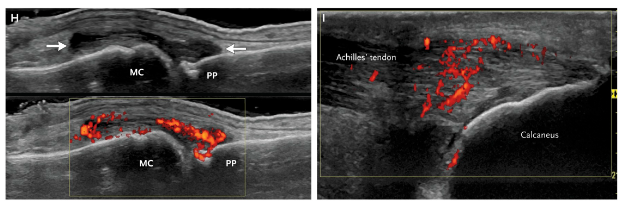
Imagem H mostra sinais de sinovíte com power doppler positivo na metacarpofalangeana no ultrassom.
Imagem I mostra sinais de entesite no tendão calcâneo com power doppler positivo no ultrassom.
Na avaliação ungueal o exame histopatológico quase nunca é realizado, por ser invasivo e poder causar cicatriz definitiva. Mas às vezes se faz necessário, por exemplo, quando o acometimento ungueal é isolado, sem outras alterações dermatológicas. O clipping (coleta superficial, sem necessidade de anestesia) tem a vantagem de ser menos invasivo, mas os resultados são pobres.9 Assim como na apresentação clínica, os achados histopatológicos da psoríase ungueal variam de acordo com a região anatômica acometida (leito ungueal, matriz, lâmina ungueal, hiponíquio ou dobras). Por exemplo, o pitting ungueal costuma ser visualizado na biopsia com acantose, adelgaçamento suprapapilar da epiderme e paraceratose. A psoríase do leito ungueal exibe muitas características da psoríase cutânea, como falta da zona granular, vasos sanguíneos dilatados, hiperceratose e paraceratose. Hemorragias em estilhaços subungueais são o equivalente ao sinal de Auspitz, quando os vasos localizados nas cristas longitudinais, após pequenos traumas, sofrem hemorragias.
Triagem para pacientes com psoríase cutânea
Ao contrário da artrite reumatoide, que não tem um benefício claro iniciar o tratamento para pacientes com manifestações subclínicas, na artrite psoríásica muitos pacientes se qualificariam para terapia destinada a pele e que teria um ação também na parte musculoesquelética, sem aumentar custos ou possíveis novas toxicidades.
Embora 70% dos pacientes com psoríase podem não apresentar Aps o risco e a compreensão dos fatores imunogenéticos e outros ligados à evolução da doença permanecem não totalmente compreendidos.
Pessoas com PsO devem ser informadas sobre o risco de desenvolver APs e solicitadas a relatar seus sintomas para facilitar o reconhecimento precoce de Aps.
Entre os fatores de risco, alguns estão associados a um risco de curto prazo e outros a um risco de médio/longo prazo.
Fatores de risco, incluindo doença ungueal, obesidade e gravidade da PsO, podem estar mais associados ao risco de APs no período de médio/longo prazo. A predisposição familiar, principalmente ter parente de primeiro grau com AP, também pode ser considerada um fator de risco para o desenvolvimento de AP
A sintomatologia articular, principalmente artralgia, e anormalidades de imagem ou sua combinação foram consideradas para a definição de AP subclínica e estas, particularmente quando combinadas, podem ser consideradas como fatores de risco de curto prazo para o desenvolvimento de AP. Podendo ser classíficada com subclínica, no qual não tem evidência clara de artrite, porém com sintomas/imagem sugestiva (alguns autores consideram dor articular com imagem evidênciando inflamação já como doença manifestada). No entanto, anormalidades isoladas de imagem, ou seja, na ausência de sintomas articulares, também foram associadas ao desenvolvimento subsequente de AP. Porém dada a elevada prevalência de anomalias imagiológicas, na gama de 40-50% em pessoas com PsO completamente assintomáticas, deve-se ter cautela em indicar alguma terapia focada para esses casos.
Identificar esses fatores de risco é importante pois esses pacientes apresentam um risco mais elevado de Aps, podendo modificar a escolha do tratamento de PsO em direção a um composto que tenha eficácia comprovada em PsO e Aps.
Os fatores de risco para o desenvolvimento de APs devem ser avaliados regularmente ao longo do tempo
Estudos prospectivos longitudinais são necessários para estabelecer o impacto potencial das terapias administradas à pele ou às unhas na atenuação, atraso ou interceptação da AP.
A presença de PsO e sinovite clínica foi considerada a marca clínica do novo início de APs. Como a dactilite está associada à sinovite e à tenossinovite e é uma característica da AP, ela pode ser incluída no inchaço das articulações que está ligado à apresentação da AP. A quantidade de articulação inflamada no início pode ser pequena (variando de 1,5 a 3,2). Uma vez que outras possíveis causas de sinovite em pessoas com PsO estão excluídos, início agudo de artrite (ou seja, geralmente definido como início súbito de mono-oligoartrite) deve ser considerado como possível AP (isso levou a não especificar uma duração mínima – como na artrite reumatoide 6 semanas por exemplo).
Uma vez que a PsO precede a AP em cerca de 70% dos casos e representa um biomarcador clínico facilmente identificável no exame clínico, existe um grupo de pessoas em risco potencialmente identificável que poderia beneficiar da prevenção, intercepção da AP e/ou de um diagnóstico precoce
Prevenção seria pessoas com PsO com fatores de risco para AP (por exemplo, envolvimento grave da pele, envolvimento das unhas, obesidade), mas sem características ou sintomas.
Intercepção seria para APs subclínica ou manifestada com sinovite.
Por isso a importância de uma colaboração estreita entre dermatologistas e reumatologistas.
A AP pode apresentar-se -ou evoluir clinicamente- de forma heterogênea, afetando outros domínios musculoesqueléticos, simultaneamente ou não. Além disso, imitadores de APs (por exemplo osteoartrite, fibromialgia, gota) podem complicar o processo diagnóstico, por isso a avaliação do reumatologista é fundamental.
Imagens (incluindo ultrassonografia e ressonância magnética) em pessoas com APs podem ser usadas para ajudar a identificar pessoas em risco de APs; em particular para detectar envolvimento/ anormalidade sinovio-enteseal. O papel da inflamação subclínica detectada por imagem como preditor do desenvolvimento posterior de APs é uma questão de pesquisa em andamento. Por isso anormalidades de imagem na ausência de sintomas musculoesqueléticos devem ser consideradas cuidadosamente para evitar o risco de tratamento inadequado. Os achados subclínicos detectados por imagem podem estar presentes na fase subclínica da AP, mas não há evidências de que isso deva favorecer escolhas terapêuticas específicas no manejo de pessoas com PsO sem sintomas musculoesqueléticos ou ser suficiente para o diagnóstico de AP.
- Avaliação de acometimento periférico por dermatologista para encaminhar ao reumatologista
PSORIASIS EPIDEMIOLOGY SCREENING TOOL (PEST):
1) Você já apresentou alguma articulação edemaciada?
2) Algum médico já disse que você tem artrite?
3) Alterações nas unhas (mãos e pés) com buracos?
4) Dor no calcanhar?
5) Já apresentou dactilite (dedo da mão ou do pé completamente inchado e dolorido sem motivo aparente)?
Se 3 ou mais respostas com Sim encaminhar ao reumatologista
Outras ferramentas de avaliação de triagem são: ToPAS II e PASE.
- Avaliação de acometimento axial por dermatologista para encaminhar ao reumatologista.
1)Você tem mais de 18 anos?
2)Tem diagnóstico confirmado de psoríase?
3)Você sente dor nas costas?
4)A sua dor nas costas é crônica (>3 meses)
5)A dor nas costas iniciou antes dos 45 anos de idade?
6)Fez uso de DMARDs sintético ou biológico nas ultimas 12 semanas
Se as respostas de 1 até 5 positivas e a 6 negativa encaminhar ao reumatologista
Patogênese
Uma base genética predisponente na presença de fatores ambientais, como infecções, microbiota (disbiose), obesidade, estresse biomecânico nas enteses (fenômeno de Koebner “profundo”) ou tabagismo pode ativar o sistema imunológico inato e precipitar o aparecimento da doença.
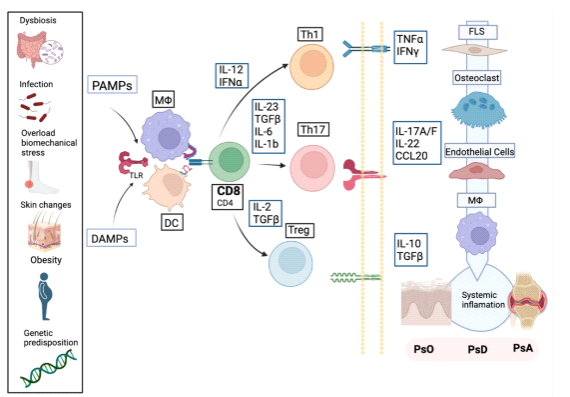
Genética: A artrite psoriática e a PsO têm um forte componente hereditário.A região genética do complexo principal de histocompatibilidade (MHC) no braço curto do cromossomo 6 contém vários alelos ou haplótipos de antígeno leucocitário humano (HLA) classe I que estão associados a um risco aumentado de PsO e PsA.HLA-B*27, HLA-B*39, HLA-B*38 e HLA-B*08 estão associados ao risco de AP, mas HLA-B*27 e HLA-B*39 também estão associados a um tempo mais curto tempo entre o início da PsO e da APs.Outras associações genótipo-fenótipo são: HLA B * 08.01 com sacroileíte assimétrica, artrite periférica, anquilose e aumento do dano articular, enquanto o HLAB * 27 está associado a sacroileíte simétrica, dactilite e entesite. Polimorfismos de nucleotidios únicos também são descritos.
Epigenética: as modificações epigenéticas têm um papel potencial no início da doença, atividade, resposta ao tratamento e progressão em doenças inflamatórias imunomediadas
Microbioma/disbiose: A disbiose é o desequilíbrio na composição, distribuição ou atividades metabólicas das espécies comensais que compõem a microflora normal das barreiras do corpo humano.A interação entre o microbioma e o sistema imunológico é responsável por muitos mecanismos imunorreguladores, e a disbiose leva a alterações na permeabilidade da barreira e a consequente ativação do sistema imunológico e a secreção de citocinas pró-inflamatórias desestabiliza as junções entre as células epiteliais e aumenta o intestino ou a pele permeabilidade, permitindo a penetração de micróbios. Em pacientes com espondiloartrite (EpA), incluindo AP, sugere-se que o linfócitos inatos do tipo 3 eleva os níveis de IL-17A e IL-22, perpetuando a inflamação e rompendo a barreira intestinal.Além disso, a disbiose em pacientes com SpA aumenta a permeabilidade do epitélio intestinal e imprimindo células Th9 para migrarem para a articulação.
Estresse biomecânico: carga mecânica é um fator importante na saúde e doença musculoesquelética. Tendões e ligamentos requerem níveis fisiológicos de carga mecânica para desenvolver e manter a arquitetura do tecido. Os níveis patológicos de força representam um estresse biológico (mecânico) que desencadeia uma via de reparo tecidual mediada pelo sistema imunológico em tendões e ligamentos. mecanoestimulação de células mesenquimais induz CXCL1 e CCL2 ao recrutamento de monócitos clássicos, que podem se diferenciar em osteoclastos reabsorventes ósseos. Portanto, a carga biomecânica atua como fator decisivo na transição da autoimunidade sistêmica para a inflamação articular.Assim, a tensão mecânica controla a localização específica do local da inflamação e do dano tecidual na artrite.A entese é o local anatômico onde os tendões, ligamentos e cápsula articular se fixam ao osso e está sujeito à sobrecarga biomecânica, sendo suscetível ao estresse mecânico (microtrauma) que induz a liberação de citocinas e fatores de crescimento, levando à sinovite secundária.
Obesidade:Em pacientes com AP, um estudo descobriu que as chances de obesidade eram maiores do que em pacientes com AR, PsO e população em geral.Além disso, um índice de massa corporal (IMC) mais elevado tem sido associado a um risco aumentado de PsO e AP.A leptina é uma adipocina considerada um elo entre os sistemas neuroendócrino e imunológico, com múltiplos efeitos relevantes para a patogênese da APs. A obesidade tem o potencial de ativar muitas das vias imunoinflamatórias conhecidas subjacentes à patogênese da AP.
Fumar: tem sido positivamente associado ao risco de AP na população em geral.
Infecções: funcionam como um gatilho para o sistema imunológico desenvolver uma doença imunomediada. A infecção por Streptococcus tem sido intimamente ligada ao desenvolvimento de PsO gutata.
Localmente, esses fatores ativam os receptores Toll-like (TLRs) tipo 2 presentes nas células apresentadoras de antígenos (APC), principalmente monócitos, células dendríticas (DC) e macrófagos, estimulando a liberação de IL-1, IL-6, TNFα, IL-17 e IL-23 através de padrões moleculares associados a patógenos exógenos (PAMPs) e/ou padrões moleculares associados a danos endógenos (DAMPs).Além disso, outras células encontradas localmente nos tecidos podem contribuir para a fisiopatologia, como células linfóides inatas (ILC), células natural killer (NK) e células T invariantes associadas à mucosa.
Embora a IL-17 seja fundamental para a fisiopatologia da AP, outras citocinas são necessárias para orquestrar as vias de sinalização. IL-23 é a chave para a diferenciação das células Th17 e Th22. Além disso, a IL-23 estimula as células T αβ, as células T γδ e ILC3 a produzir IL-17, IL-22, TNFα e IFN-γ, promovendo alças inflamatórias típicas de citocinas que levam à inflamação persistente. Por outro lado, a IL-22 dependente de IL-23 pode induzir a fosforilação de STAT3 em osteoblastos em locais de entese, levando à formação óssea . Além disso, a IL-22 regula negativamente a diferenciação dos queratinócitos, induzindo hiperqueratose. Finalmente, TNFα, IL-17 e IL-23 induzem a ativação da via NF-κB, promovendo a síntese de mais citocinas pró-inflamatórias.
Diagnóstico
O diagnóstico precoce da AP é uma pedra angular importante no tratamento da AP, uma vez que mesmo um atraso no diagnóstico tão curto quanto 6 meses pode levar a danos radiográficos nas articulações significativamente mais graves, pior função física e diminuir o sucesso terapêutico.
É uma condição heterogênea com envolvimento musculoesquelético, incluindo artrite periférica, entesite, dactilite e envolvimento axial, bem como potencial doença de pele e unhas.
Os pacientes devem ser cuidadosamente avaliados quanto a esses domínios, entendendo-se que várias combinações de domínios podem estar presentes.
Avaliar história familiar, manifestações extra musculoesqueléticas (uveíte, doença inflamatória intestinal), avaliação ungueal e cutânea detalhada, sintomas axiais.
Dado que 10-15% dos pacientes desenvolvem artrite antes da psoríase (história familiar de psoríase, envolvimento músculo-esquelético típico e sorologia negativa pode ajudar).
Psoríase cutânea em 80% e doença ungueal em 60% dos casos
Às vezes, a psoríase fica “oculta” e não é facilmente identificada em áreas como couro cabeludo, unhas, áreas de flexão e genital. Sendo necessário avaliação completa no exame físico.
O diagnóstico da artrite psoriática baseia-se no reconhecimento de características clínicas e de imagem, uma vez que não existem biomarcadores específicos
Osteoartrite ou dor lombar mecânica é sempre um diagnóstico diferencial em pacientes com psoríase e dor articular/lombar.
Fator reumatoide geralmente negativo.
- Critérios CASPAR (classificatórios): necessário 3 pontos (98,7% especificidade e 91,4% sensibilidade)
Doença articular inflamatória (articulação, coluna vertebral ou enteseal), com três ou mais pontos dos seguintes:
Psoríase atual (2 pontos) / História pessoal de psoríase (1 ponto) / História familiar (1 ponto)
Distrofia ungueal psoriásica(1 ponto)
Dactilite(1 ponto)
Fator reumatoide negativo(1 ponto)
Evidência de neoformação óssea justa-articular em rx de mãos/pés(1 ponto)
- Diferenciais:
Artrite reumatóide, osteoartrite, gota, pseudogota, lúpus eritematoso sistêmico e outras formas de espondiloartrite.
A artrite reumatóide é caracterizada por envolvimento proximal e simétrico das articulações das mãos e dos pés, com preservação das articulações interfalângicas distais, enquanto em mais de 50% dos pacientes com artrite psoriática as articulações distais são afetadas; o envolvimento tende a ser caracterizado por uma distribuição em “raio”, com todas as articulações do mesmo dígito envolvidas e os outros dígitos poupados. Isso é perceptível tanto clínica quanto radiograficamente. No início, a artrite psoriática tende a ser oligoarticular e menos simétrica do que a artrite reumatóide, embora com o tempo a artrite psoriática possa tornar-se poliarticular e simétrica.
A espondilite anquilosante geralmente começa no final da segunda década de vida ou no início da terceira década, enquanto a espondiloartrite psoriática tem maior probabilidade de se desenvolver na quarta década de vida. A espondiloartrite psoriática pode ser menos grave que a espondilite anquilosante, com menos dor e anquilose infrequente da articulação sacroilíaca; uma distribuição assimétrica de sindesmófitos.
Pode ser difícil distinguir entre artrite psoriática e artrite reativa. Ambas as condições podem estar associadas a lesões articulares e cutâneas, e as lesões cutâneas podem ser difíceis de atribuir patologicamente a uma condição ou outra. As lesões psoriasiformes do lúpus cutâneo subagudo podem mimetizar a psoríase vulgar, mas os pacientes com lúpus cutâneo não apresentam as outras características definidoras da artrite psoriática.
Tratamento
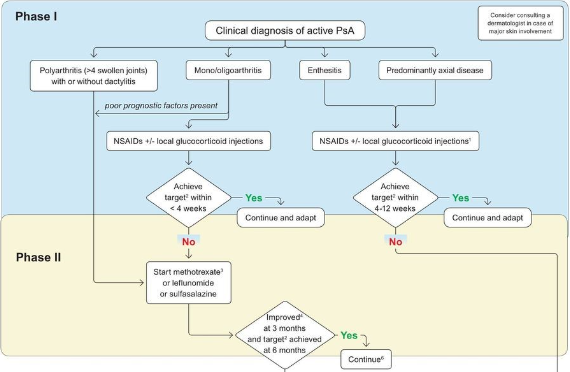
As decisões terapêuticas precisam ser individualizadas e tomadas em conjunto pelo paciente e seu médico. O tratamento deve refletir as preferências do paciente, sendo-lhes fornecidas as melhores informações sobre as opções relevantes.
As escolhas de tratamento podem ser afetadas por vários fatores, incluindo atividade da doença, terapias anteriores, fatores prognósticos como danos estruturais, comorbidades e fatores do paciente como custo, conveniência e escolha.
– Objetivos:
Alcançar o nível mais baixo possível de atividade da doença em todos os domínios da doença. À medida que as definições de remissão e atividade baixa ou mínima da doença forem aceitas, estas serão incluídas na meta
Para otimizar o estado funcional, melhorar a qualidade de vida e o bem-estar e prevenir danos estruturais na maior medida possível
Para evitar ou minimizar complicações, tanto da doença ativa não tratada quanto da terapia.
– Medicamentos usados:
1) Apremilaste: é uma pequena molécula oral que inibe a fosfodiesterase 4 (PDE4). A inibição de PD4 promove um aumento no AMP cíclico intracelular que impede a síntese de citocinas pró-inflamatórias, como o TNF, e eleva IL 10 (antiinflamatória).
Guias de recomendação sugerem seu uso em pacientes com envolvimento cutâneo, envolvimento ungueal, AP periférica, entesite e dactilite.
2) Anti-TNF
TNFα é uma citocina pró-inflamatória mestre produzida pelas células T1 que promove a ativação de células mieloides (macrófagos e células dendriticas) e a produção de outras citocinas pró-inflamatórias, incluindo o TNF, induzindo assim inflamação sistêmica e local.
A eficácia de 5 TNFi com indicações em AP (certolizumab pegol [CZP], infliximab [IFX], adalimumab [ADA], etanercept [ETN] e golimumab [GOL]).
Eficaz em todos os domínios
3) IL 12/23
Ustecinumabe é um anticorpo monoclonal que bloqueia a subunidade p40 compartilhada de IL-12 e IL-23, inibindo a diferenciação de células Th1 e Th17. Sua eficácia foi demonstrada para pele, artrite periférica, entesite e dactilite.
4) IL 23
Mais recentemente, o guselcumab (GSK), um anticorpo monoclonal que se liga à subunidade p19 e neutraliza especificamente a IL-23. Em pacientes virgens de tratamento, bem como naqueles com exposição prévia ao TNFi a resposta ACR 20 na semana 24 foi significativamente maior para pacientes tratados com ambas as doses de GSK do que com placebo
Risankizumab (RZK), um anticorpo monoclonal IL-23.Os ensaios KEEPsAKE em pacientes sem experiência e com terapia biológica anterior mostraram que significativamente mais pacientes tratados com RZK alcançaram uma resposta ACR 20 na semana 24 do que PBO
Todos os medicamentos que neutralizam a IL-23 (GSK, RZK e UST) não demonstraram eficácia na espondiloartrite axial (axSpA) em ECRs até o momento.
Dados de modelos animais de axSpA sugerem que a IL-23 pode ser necessária para o início, mas não para a manutenção de axSpA, enquanto a IL-17 tem um papel durante toda a doença e de maneira independente da IL-23 na doença estabelecida.
A eficácia da IL-23i na AP axial (axPsA) foi explorada em uma análise post-hoc dos estudos DISCOVER, onde foram avaliados pacientes com envolvimento axial avaliado pelo médico e presença de sacroileíte na ressonância magnética (RM), sugerindo que esta meta pode ser eficaz no axPsA [ 148 ]. Atualmente, um ECR com GSK em pacientes com APs com atividade axial como resultado primário está sendo desenvolvido.
5) IL 17
O secuquinumabe (SEC), um anticorpo monoclonal totalmente humano que tem como alvo seletivo a IL-17A, foi aprovado em pacientes com AP.
SEC demonstrou eficácia superior ao PBO em vários domínios de doenças, incluindo artrite periférica, axial, dactilite, entesite e doenças de pele e unhas.
No entanto, em ensaios clínicos anteriores, o SEC não foi superior ao TNFi (ADA) nos resultados do domínio músculo-esquelético de pacientes com AP (ACR 50 como desfecho primário), mas foi superior no resultado da pele.
A incidência de infecções por Candida na AP é estimada em 1,5 por 100 pacientes-ano (PY), enquanto a incidência de doença inflamatória intestinal é de 0,03-0,1 por 100.
O ixequizumabe (IXE) também é um anticorpo monoclonal que tem como alvo seletivo a IL-17A. Assim como o SEC, o IXE demonstrou ser superior ao PBO nas respostas ACR, inibição da progressão radiográfica e outros domínios clínicos, tanto em populações refratárias ao TNFi quanto em pacientes virgens.
No ensaio clínico comparativo, o IXE foi superior ao ADA na obtenção do desfecho primário composto de ACR50 e uma melhora de 100% na resposta PASI 100 na semana 24, mas sem diferenças significativas nos domínios clínicos musculoesqueléticos no final do o estudo.
Bimekizumab (BMK) é um anticorpo monoclonal que inibe a região de IL-17 A e IL-17 F, resultando em um bloqueio de combinações de homodímeros e heterodímeros: IL-17AA, IL-17FF e IL-17AF. A inibição dupla de IL-17A e IL-17F pode fornecer melhores resultados do que o bloqueio de IL-17A sozinho. O RCT de fase 3 do BMK em AP (BE COMPLETE) incluiu pacientes previamente expostos ao TNFi, que foram randomizados para receber BMK 160 mg ou PBO. O objetivo primário foi a resposta ACR 50 na semana 16, que foi alcançada por 43% dos pacientes tratados com BMK em comparação com 7% com PBO. O PASI 90 foi alcançado na semana 16 em mais pacientes tratados com BMK vs. PBO.
Brodalumab (BRD) é um anticorpo monoclonal humano anti-receptor de interleucina-17 A (IL-17RA) que bloqueia sua ligação à IL-17 (A, F e E). Atualmente é aprovado apenas para PsO.
Os inibidores da interleucina-17 são indicados para todos os domínios de envolvimento da AP, exceto quando há DII associada. Apesar de seu bom perfil de segurança, a IL-17i não é recomendada em pacientes com DII, uma vez que não demonstra eficácia em e o possível agravamento da doença.
6) Inibidores de JAK
A família janus de quinases intracelulares consiste em quatro membros: tirosina-proteína quinase 2 (TYK2), JAK1, JAK2 e JAK3. Essas moléculas interagem com vários membros da família de transdutores de sinal e ativadores de transcrição (STAT) para modular a transcrição gênica a jusante de uma variedade de receptores de citocinas e fatores de crescimento da superfície celular.
O tofacitinibe (TOF) é uma molécula pequena que inibe especificamente JAK1 e JAK3. O RTC de fase 3 demonstrou a eficácia do TOF em relação ao PBO em pacientes com AP naive e também em pacientes que falharam com TNFi
Cuidados com pacientes com mais de 65 anos de idade, fumantes e aqueles com fatores de risco cardiovascular, história de eventos tromboembólicos ou história de malignidade.
Upadacitinibe (UPA) é uma pequena molécula que inibe JAK1.O ensaio de Fase 3, SELECT-PsA 1, demonstrou eficácia na resposta ACR20 e segurança em comparação com placebo. Além disso, o UPA 15 mg não foi inferior ao ADA, enquanto o UPA 30 mg mostrou superioridade sobre o ADA, mas também eventos adversos mais graves.Da mesma forma, os pacientes refratários ou intolerantes ao TNFi (SELECT-PsA 2) alcançaram uma resposta ACR20 e MDA significativamente maiores. Mais herpes zoster no grupo UPA.
Filgotinibe (FIL) é outro inibidor seletivo de JAK1 em desenvolvimento para o tratamento da AP. No estudo EQUATOR, um ECR de fase 2, a resposta ACR20 na semana 16 foi alcançada por 80% dos pacientes tratados com FIL e 33% daqueles tratados com PBO. Estudos de fase 3 andamento.
O deucravacitinibe (DEU) é uma pequena molécula que é um inibidor alostérico não competitivo da tirosina quinase 2 (TYK2). O estudo de fase 2 incluiu pacientes com exposição prévia ao TNFi e mostrou a eficácia de ambas as doses (6 mg e 12 mg/dia) de DEU em comparação com placebo na artrite, resolução de entesite e dactilite. Estudo fase 3 em andamento.
Brepocitinibe (BRE) é uma molécula oral com ação inibidora dupla, TYK2 e JAK1, sob investigação para o tratamento da AP. Os resultados de um ECR de fase 2 foram apresentados na convergência ACR 2021. Pacientes com uso prévio de DMARDs e aqueles com uso prévio de um TNFi foram incluídos no estudo. Uma proporção significativamente maior de pacientes tratados com BRE 30 mg (66,7%) e 60 mg (74,6%) atingiu o desfecho primário (ACR20) vs. PBO (43,4%, p < 0,05) na semana 16.
- Tratando por domínios
- Artrite periférica
Opcões: DMARDs sintéticos (MTX, SSZ, LEF); TNFi, IL-12/23i, IL-17i, IL-23i, JAKi, inibidor da fosfodiesterase 4 (apremilast), AINEs
Os AINEs e os glicocorticóides intra-articulares e orais são condicionalmente recomendados
Em muitas circunstâncias, os csDMARDs podem ser utilizados como terapia de primeira linha, sendo aconselhada uma avaliação regular da resposta clínica (a cada 12–24 semanas).
Pacientes com resposta inadequado trocar para terapia biológica.
Com base nas evidências, incluindo estudos comparativos, os inibidores de TNF, os inibidores de IL-17 e os inibidores de JAK são igualmente recomendados.
Embora a inibição da IL-23 ainda seja fortemente recomendada, ela pode ser considerada um pouco menor em termos de recomendações para uso em pacientes com artrite periférica.
Em pacientesm em uso de biológico ou DMARD alvo específico não houve diferença na eficácia dessas opções de tratamento em subgrupos de pacientes com ou sem DMARDs sintéticos simultâneos.
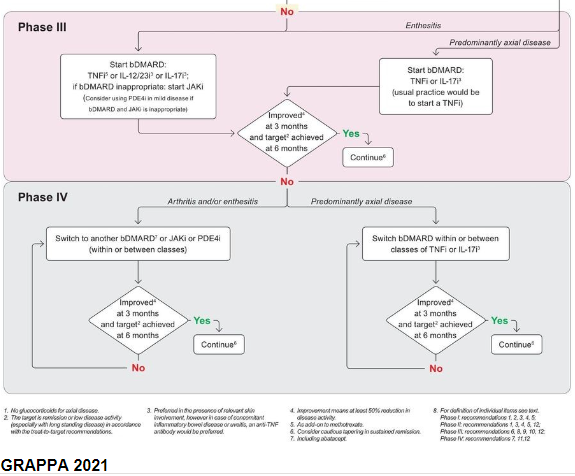
2.Doença axial
Opções: AINEs, TNFi, IL-17i, JAKi
Para pacientes com sintomas axiais que não responderam ao tratamento com AINEs , o início de uma terapia direcionada é recomendado.
A inibição do TNF e a inibição da IL-17 demonstraram eficácia tanto no axSpA radiográfico quanto no não radiográfico.
Extrapolando a partir das evidências do axSpA, recomendado JAKi também para APs axial.
Análises post hoc dos inibidores de IL-12/23 (ustequinumabe) e os inibidores de IL-23 (guselcumabe) sugerem que esses agentes podem ser eficazes na AP axial. Porém como esses estudos incluíram principalmente pacientes com APs ativa e esses agentes não se mostraram eficazes na APs ax, as evidências são atualmente muito limitadas e conflitantes, de modo que esses medicamentos não podem ser recomendados para APs axial neste momento.
3.Entesite
Opções: TNFi, IL-12/23i, IL-17i, IL-23i, JAKi, PDE4i. AINE e metotrexato como condicional.
Nenhuma das classes de medicamentos detalhadas acima foi priorizada para o tratamento da entesite nas recomendações.
4.Dactilite
Opções: TNFi, IL-12/23i, IL-17i, IL-23i, JAKi, PDE4i
Foi estabelecida uma forte recomendação para o uso de inibidores de TNF, inibidores de IL-12/23, inibidores de IL-23, inibidores de IL-17, inibidores de JAK e inibidores de PDE4, e uma recomendação condicional foi estabelecida para o uso de CTLA4-Ig no tratamento da dactilite na AP.
Recomendação condicional para o uso de metotrexato, AINEs e injeções locais de glicocorticóides.
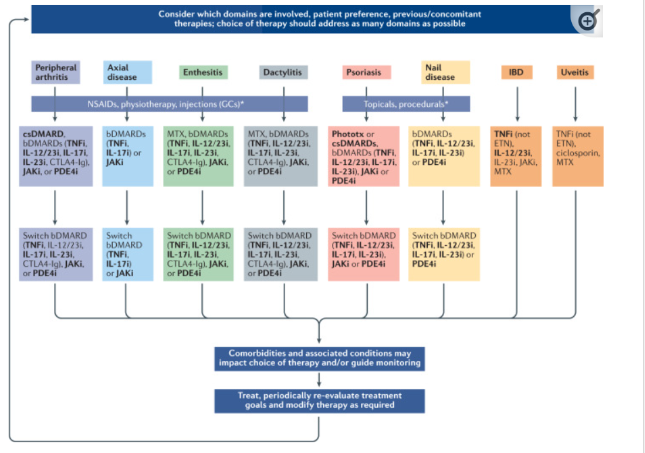
5.Psoriase placa
Terapias tópicas, fototerapia, cdDMARDs (MTX, CsA), TNFi, IL-12/23i, IL-17i, IL-23i, PDE4i, JAKi. Acitretina com opção.
Os agentes tópicos são fortemente recomendados como tratamento de primeira linha para pacientes com envolvimento limitado da superfície corporal. Para pacientes com psoríase mais disseminada ou psoríase que não responde a tópicos, fototerapia, terapias orais (metotrexato, ciclosporina, inibidores de PDE4 e inibidores de JAK) e bDMARDs (inibidores de TNF, inibidores de IL-17, inibidores de IL-12/23 e inibidores de IL-23) são fortemente recomendados. A fototerapia é eficaz para a psoríase que afeta o tronco e as extremidades. A acitretina, um retinóide oral, é condicionalmente recomendada para psoríase em pacientes com AP devido à sua eficácia limitada como monoterapia para psoríase em placas (pode ser eficaz para a psoríase pustulosa).
Fortes recomendações para inibidores de TNF, inibidores de IL-17, inibidores de IL-12/23 e inibidores de IL-23.
IL-17, IL-12/23 e IL-23 são mais eficazes para pele do que iTNF
6.Psoriase ungueal
Opções: TNFi, IL-12/23i, IL-17i, IL-23i, PDE4i. Como opção iJAK, dmard sintético, terapia tópica (preparações de calcipotriol e glicocorticóides, tacrolimus tópico, ciclosporina tópica, glicocorticóides intralesionais e laser pulsado).
inibidores de TNF, inibidores de IL-17, inibidores de IL-12/23 e inibidores de IL-23, são fortemente recomendados para o tratamento da doença psoriásica das unhas
7.Doença inflamatória intestinal
TNFi (não ETN), IL-12/23i. Como opções IL-23i, JAKi, MTX. Não recomendado anti IL17
Vários ECRs de alta qualidade demonstraram a eficácia dos inibidores do TNF (com exceção do etanercepte, que não demonstrou eficácia) e dos inibidores da IL-12/23 para a doença de Crohn e colite ulcerativa.
Para a inibição de JAK, embora o tofacitinib tenha sido eficaz na colite ulcerosa, um único ECR de fase II na doença de Crohn não atingiu o seu desfecho primário. No entanto, resultados promissores estão surgindo de ECRs de fase II para a eficácia e segurança de outros inibidores de JAK (upadacitinibe e filgotinibe) e inibidores de IL-23 tanto na doença de Crohn quanto na colite ulcerativa. Para o metotrexato, que é utilizado na prática clínica, os dados de alguns ECR demonstraram eficácia na doença de Crohn e na colite ulcerosa.
8.Uveíte
TNFi (não ETN), CsA, MTX
EULAR recomendações 2019
Comorbidades
A psoríase e a AP estão ambas associadas a várias condições crônicas que podem influenciar a escolha do tratamento, a resposta ao tratamento, a qualidade de vida e a mortalidade.
As comorbidades de particular importância na AP incluem doença cardiovascular (DCV), obesidade, síndrome metabólica, doença hepática (doença hepática gordurosa em particular), distúrbios de humor, incluindo depressão e ansiedade, infecções crônicas (hepatite B, hepatite C, HIV, tuberculose e infecções fúngicas), malignidade (por exemplo, câncer de pele e linfoma), osteoporose e fibromialgia e/ou sensibilização central.
O risco cardiovascular é elevado em pacientes com AP em comparação com a população geral de mesma idade e sexo. Os pacientes devem ser examinados quanto a fatores de risco cardiovascular e os fatores de risco modificáveis devem ser gerenciados para melhorar os resultados cardiovasculares nesta população de pacientes.
A obesidade está associada à redução da capacidade funcional, maior gravidade da psoríase e atividade da doença e redução da resposta à terapia.
A doença hepática gordurosa é comum em pacientes com AP e está frequentemente relacionada à obesidade e/ou diabetes mellitus.
O herpes zoster pode ser uma complicação das terapias imunomoduladoras, embora este risco pareça ser maior com os inibidores de JAK do que com outras terapias imunomoduladoras. Os reumatologistas devem aconselhar os pacientes sobre este risco e encorajar a vacinação antes de iniciar a terapia, quando possível.
A vigilância e o tratamento da osteoporose devem ser iguais em pacientes com AP e na população em geral.
Referências
- Coates, L.C., Soriano, E.R., Corp, N. et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA): updated treatment recommendations for psoriatic arthritis 2021. Nat Rev Rheumatol 18, 465–479 (2022).
- Gossec L, Baraliakos X, Kerschbaumer A, et al.EULAR recommendations for the management of psoriatic arthritis with pharmacological therapies: 2019 update.Annals of the Rheumatic Diseases 2020;79:700-712.
- Laura Coates and Laure Gossec. The updated GRAPPA and EULAR recommendations for the management of psoriatic arthritis: Similarities and differences. Joint Bone Spine, 2023.
- Farzad Alinaghi and Monika Calov and Lars Erik Kristensen and Dafna D. Gladman and Laura C. Coates and Denis Jullien and Alice B. Gottlieb and Paolo Gisondi and Jashin J. Wu and Jacob P. Thyssen and Alexander Egeberg. Prevalence of psoriatic arthritis in patients with psoriasis: A systematic review and meta-analysis of observational and clinical studies. ournal of the American Academy of Dermatology, 2019.
- Coates LC, Helliwell PS. Psoriatic arthritis: state of the art review. Clin Med (Lond). 2017 Feb;17(1):65-70. doi: 10.7861/clinmedicine.17-1-65. PMID: 28148584; PMCID: PMC6297592.
- Azuaga, A.B.; Ramírez, J.; Cañete, J.D. Psoriatic Arthritis: Pathogenesis and Targeted Therapies. Int. J. Mol. Sci. 2023, 24, 4901. https://doi.org/10.3390/ijms24054901
- Ritchlin, Christopher T, et al. Psoriatic Arthritis. New England Journal of Medicine.2017/03/09. doi: 10.1056/NEJMra1505557
- Rich, Phoebe, et al.Nail psoriasis severity index: a useful tool for evaluation of nail psoriasis. Journal of the American Academy of Dermatology, 2003.
- Paci V, Luchetti MM, Cimaroli I, et alPOS0878 SCREENING FOR THE EARLY IDENTIFICATION OF PSORIATIC ARTHRITIS WITH AXIAL INVOLVEMENT (AXPSA) IN A COHORT OF ITALIAN PATIENTS AFFECTED BY PSORIASIS: RESULTS OF A DERMO-RHEUMATOLOGIC CROSS-SECTIONAL STUDY (ATTRACT)Annals of the Rheumatic Diseases 2023;82:744-745.
- Proft F, Lüders S, Hunter T et al. Early identification of axial psoriatic arthritis among patients with psoriasis: a prospective multicentre study. Ann Rheum Dis 2022;81:1534–40.
- Alen Zabotti, Gabriele de Marco, Laure Gossec, Xenofon Baraliakos, Daniel Aletaha, et al.. EULAR points to consider for the definition of clinical and imaging features suspicious for progression from psoriasis to psoriatic arthritis. Annals of the Rheumatic Diseases, In press, pp.ard-2023-224148. ff10.1136/ard-2023-224148ff. ffhal-04141169f
- Karmacharya, P., Crowson, C.S., Bekele, D., Achenbach, S.J., Davis, J.M., III, Ogdie, A., Duarte-García, A., Ernste, F.C., Maradit-Kremers, H., Tollefson, M.M. and Wright, K. (2021), The Epidemiology of Psoriatic Arthritis Over Five Decades: A Population-Based Study. Arthritis Rheumatol, 73: 1878-1885. https://doi.org/10.1002/art.41741
- Rossetto CN, et al. Epidemiological analysis of patients with psoriatic arthritis in follow-up at the brazilian Unified Health System. Adv rheumatol. 2023; 63:47.
- Tucker LJ, Coates LC, Helliwell PS. Assessing Disease Activity in Psoriatic Arthritis: A Literature Review. Rheumatol Ther. 2019 Mar;6(1):23-32. doi: 10.1007/s40744-018-0132-4. Epub 2018 Nov 23. PMID: 30471015; PMCID: PMC6393266.
- Mohamad Ali Rida, et al. Challenges in the clinical diagnosis of psoriatic arthritis, Clinical Immunology, Volume 214, 2020.