Introdução
A supressão do eixo hipotálamo-hipófise-adrenal (HPA) é um efeito inevitável da terapia crônica com glicocorticoides (GC) exógenos e a recuperação da função adrenal varia muito entre os indivíduos.
Os glicocorticoides suprimem a atividade do eixo HPA ao inibir a produção do hormônio liberador de corticotropina (CRH) pelo hipotálamo e do hormônio adrenocorticotrófico (ACTH) pela hipófise. A inibição de CRH e ACTH induzida por glicocorticoides exógenos é semelhante aos mecanismos envolvidos no feedback negativo fisiológico do cortisol.
A duração prolongada da terapia suprafisiológica com glicocorticoides muitas vezes leva a uma redução na capacidade de resposta global da glândula pituitária anterior.
O grau e a persistência da supressão do eixo HPA após a interrupção da terapia com glicocorticoides dependem da exposição geral, que, entre outros fatores, é determinada pela potência do GC, dose de GC, duração da terapia e suscetibilidade individual. Notavelmente, qualquer via de administração tem potencial de supressão do eixo HPA, incluindo administração oral, tópica, inalada, intranasal, intravenosa e intra-articular.
Dose de terapia com GC que representa risco de insuficiência adrenal : qualquer dose superior ao equivalente diário de hidrocortisona de 15-25 mg (4-6 mg de prednisona ou prednisolona, 3-5 mg de metilprednisona, 0,25-0,5 mg de dexametasona). Usados por mais de 3 a 4 semanas.
Durante a redução inicial dos glicocorticoides, os níveis de ACTH e cortisol permanecem suprimidos. Quando a dose da terapia com glicocorticoides é reduzida, o hipotálamo e a glândula pituitária começam a se recuperar, resultando no aumento da produção de ACTH. O aumento do ACTH pode promover a recuperação da função adrenal levando ao aumento e recuperação do cortisol. A recuperação completa da produção de cortisol pode permanecer prejudicada numa minoria de pacientes
Alguns estudos, avaliando testes bioquímicos para o diagnóstico de insuficiência adrenal (e não sintomas), uma porcentagem de acometimento de 4,2% para uso nasal, 48,7% nasal combinado com oral, e 52% para uso intra-articular.
Recomendações
Os médicos que prescrevem terapia com GC suprafisiológicos de longo prazo devem educar ativamente seus pacientes sobre o potencial desenvolvimento de manifestações adversas associadas.

Pacientes que usam corticoide por menos de 3 a 4 semanas, independente da dose, não tem necessidade de realizar retirada gradual, podendo ser interrompidos. Não há evidências de que esses curtos períodos de tratamento levem à supressão clinicamente relevante do eixo HPA.
Nos pacientes que fazem uso prolongado de corticoide, após o controle da doença doença de base e quando for possível iniciar a retirada do medicamento, os GC são gradualmente reduzidos até se aproximar do equivalente fisiológico da dose diária (por exemplo, 4-6 mg de prednisona).
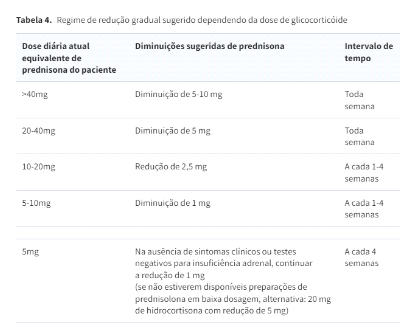
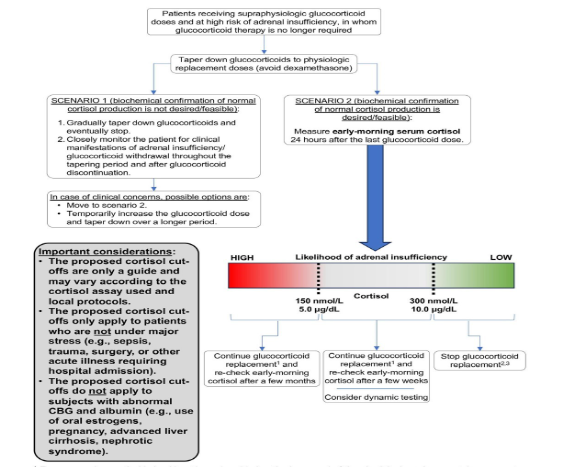
Quando o paciente já está recebendo uma dose fisiológica, e tem objetivo de suspender o corticoide. A retirada por ser feita observado sinais e sintomas de insuficiência adrenal ou com teste do cortisol sérico matinal 24h após a última dose de corticoide.
Se o paciente não tem indicação de suspender o corticoide ou está em dose acima da fisiológico não tem necessidade de estar realizando teste do cortisol sérico.
É um guia:
- Sugerimos que o teste indique recuperação do eixo HPA se o cortisol for >300 nmol/L ou 10 μg/dL e os glicocorticoides puderem ser interrompidos com segurança;
- Sugerimos que se o resultado estiver entre 150 nmol/L ou 5 μg/dL e 300 nmol/L ou 10 μg/dL, a dose fisiológica de glicocorticoide deve ser continuada e o cortisol matinal repetido após um período de tempo apropriado (geralmente semanas a meses);
- Sugerimos que se o resultado for <150 nmol/L ou 5 μg/dL, a dose fisiológica de glicocorticoide deve ser mantida e o cortisol matinal repetido após alguns meses.
Os pacientes podem diminuir gradualmente os glicocorticoides enquanto são monitorados cuidadosamente quanto a manifestações clínicas de insuficiência adrenal. Se o paciente apresentar sinais e sintomas de insuficiência adrenal, o regime de glicocorticoides deve ser reiniciado e não descontinuado até que a recuperação do eixo HPA seja documentada. Se o paciente não apresentar nenhum sintoma, a redução gradual prossegue até a descontinuação do glicocorticoide.
Alternativamente, os pacientes podem ser submetidos a testes com cortisol sérico matinal (amostra coletada entre 8h e 9h) para determinação da recuperação do eixo HPA. Se a insuficiência adrenal for documentada, o glicocorticoide exógeno não deve ser reduzido abaixo do limite inferior dos intervalos de dose de reposição fisiológica para garantir a reposição adequada da insuficiência adrenal, proporcionando ainda um estímulo para a recuperação do eixo HPA.
Deve-se enfatizar que os testes bioquímicos para insuficiência adrenal são sensíveis, mas não específicos. A persistência da supressão bioquímica ou a recuperação insuficiente do eixo HPA é um pré-requisito para a insuficiência adrenal clínica, mas mesmo entre os pacientes com insuficiência bioquímica, o risco de insuficiência adrenal clinicamente significativa e crise adrenal permanece muito baixo. Devido à baixa prevalência de insuficiência adrenal clinicamente relevante, apesar da alta prevalência de insuficiência adrenal bioquímica após uma redução gradual de glicocorticoides, os testes podem fornecer uma salvaguarda na identificação daqueles com menor risco
Em pacientes com níveis séricos de cortisol mais elevados, mas abaixo de 300 nmol/L (10 μg/dL), a recuperação do eixo HPA é possível. Nesses casos, sugerimos que a estratégia mais custo-efetiva e prática é que esses pacientes continuem com a reposição fisiológica de glicocorticoides em dose diária equivalente e tenham o cortisol sérico matinal reavaliado a cada poucas semanas até que ocorra a recuperação. Se os níveis de cortisol permanecerem entre 150 nmol/L (5 μg/dL) e 300 nmol/L (10 μg/dL), o teste dinâmico ( com estímulo de ACTH) pode ser considerado.

A insuficiência adrenal induzida por glicocorticoides pode ocorrer com qualquer formulação de glicocorticoides e não existe um nível seguro estabelecido de exposição à dose.
Risco maior para corticoide não oral: corticoide inalatório por mais de 12 meses com altas doses (principalmente se associado com corticoide oral); infiltração intra articular repetidas em menos de 3 meses (acetonido de triancinolona tem risco maior que o hexacetonido); uso de corticoide tópico de alta potência por longos períodos em pele inflamada; uso a longo prazo de corticoide intranasal.
Altas doses de glicocorticoides inalados comumente prescritos em adultos são:
- Propionato de fluticasona >500 μg/dia
- Dipropionato de beclometasona (inaladores de partículas padrão) > 1000 μg/dia
- Dipropionato de beclometasona (inaladores de partículas extrafinas) > 400 μg/dia
- Budesonida >800 μg/dia
- Ciclesonida >320 μg/dia
- Furoato de fluticasona >200 μg/dia
- Partícula padrão de furoato de mometasona >400 μg/dia
Faltam evidências robustas sobre o impacto das injeções intra-articulares de glicocorticoides no eixo HPA. Os glicocorticoides podem ser detectados na urina durante meses após as injeções, sugerindo absorção sistêmica prolongada. Sugerimos que os pacientes sejam monitorados quanto a sinais e sintomas de insuficiência adrenal e que os profissionais de saúde tenham um limiar baixo para testes, especialmente dentro de 2 meses após as injeções e em pacientes que recebem injeções simultâneas ou múltiplas durante um curto período. As preparações intra-articulares de glicocorticoides comumente usadas geralmente levam a uma supressão de 4 semanas e, portanto, são esperados valores baixos de cortisol matinal durante esse período, e a recuperação pode ser confirmada nas 4 semanas seguintes.
A maioria dos glicocorticoides é metabolizada pelo citocromo hepático P450 3A4 (CYP3A4). Inibidores fortes do CYP3A4 – que incluem ingredientes alimentares como sumo de toranja, vários antibióticos, antifúngicos e o inibidor da protease ritonavir, entre outros – demonstraram aumentar significativamente as concentrações circulantes de glucocorticoides
Considerar a síndrome de abstinência de GC que pode ocorrer durante a redução gradual dos GC. Quando a síndrome de abstinência de GC é grave, a dose de GC pode ser temporariamente aumentada para a dose mais recente tolerada e a duração da redução gradual dos GC pode ser aumentada. Mal-estar geral, fadiga, náusea, dores musculares e articulares, distúrbios do sono, alterações de humor. Essa abstinência é definida com sintomas experimentados ao reduzir a dose de GC dentro da faixa de dose suprafisiológica de GC, que não são devidos à doença subjacente para a qual os GC foram inicialmente prescritos e, por definição, não são devidos à insuficiência adrenal não tratada, uma vez que a dose diária total de GC é ainda suprafisiológico
Pacientes com tratamento atual ou anterior com glicocorticoides apresentando sinais e sintomas de síndrome de Cushing exógena sejam considerados como portadores de insuficiência adrenal induzida por glicocorticoides.
Pacientes que pretendem descontinuar os glicocorticoides, mas sem recuperação do eixo HPA em um ano, enquanto estiverem em dose fisiológica diária equivalente, sejam avaliados por um especialista em endocrinologia.
Não recomendamos o uso de fludrocortisona em pacientes com insuficiência adrenal induzida por glicocorticoides. A secreção do mineralocorticoide aldosterona é amplamente regulada pelo sistema renina-angiotensina e pelos níveis de potássio. Consequentemente, espera-se que a função mineralocorticoide seja preservada na insuficiência adrenal induzida por glicocorticoides, como em outras formas de insuficiência adrenal secundária ou terciária.
Recomendamos que pacientes com uso atual ou recente de glicocorticoides que não foram submetidos a testes bioquímicos para descartar insuficiência adrenal induzida por GC recebam cobertura de dose de estresse quando expostos ao estresse
Os glicocorticoides orais devem ser usados em caso de estresse menor e quando não há sinais de instabilidade hemodinâmica ou vômitos ou diarreia prolongados.
A dose de estresse recomendada de hidrocortisona é a mesma que para pacientes com insuficiência adrenal primária ou secundária de outra etiologia: os pacientes devem receber o dobro da dose de reposição fisiológica (isto é, hidrocortisona 40 mg por dia, geralmente dividida em três doses: 20 mg ao levantar, 10 mg 12h, 10mg, 17h). Em pacientes que utilizam outras formulações de glicocorticoides, é sugerida uma dose equivalente a 40 mg de hidrocortisona e este regime precisa ser oferecido durante o período de estresse, por exemplo, prednisona 10 mg, dose diária total a ser administrada em uma ou duas doses divididas. Continue por 2 a 5 dias até ficar bem (ou durante o tratamento com antibióticos).
Os glicocorticoides parenterais devem ser usados em caso de estresse moderado a grande, procedimentos sob anestesia geral ou regional, procedimentos que exijam evitação prolongada ou incapacidade de ingestão oral, ou quando houver sinais de instabilidade hemodinâmica ou vômitos ou diarreia prolongados. Hidrocortisona 100 mg em bolus IV ou injeção IM imediatamente, seguida de início imediato de uma infusão contínua de hidrocortisona 200 mg durante 24 horas. Se uma infusão contínua não for viável, administre hidrocortisona 50 mg em bolus IV a cada 6 horas. A duração e a dose do regime de glicocorticoides devem ser individualizadas com base no tipo de estressor e no estado clínico do paciente.
Insuficiência adrenal:
- Os pacientes apresentam um choque desproporcional à gravidade do gatilho, se um gatilho for identificado (veja abaixo).
- O choque é tipicamente resistente a inotrópicos e à reposição volêmica se a crise adrenal não for reconhecida e tratada prontamente com glicocorticoides parenterais.
- Os fatores de risco para crises adrenais incluem história de crises adrenais anteriores, idade avançada (>65 anos), adolescência e transição do cuidado pediátrico para o adulto, e uma maior carga de comorbidades.
- A redução gradual e a descontinuação dos glicocorticoides são momentos cruciais, uma vez que a insuficiência adrenal induzida por glicocorticoides pode tornar-se clinicamente aparente.
Diagnóstico: hipotensão ou choque hipovolêmico mais pelo menos um dos seguintes:
- Náusea ou vômito.
- Fadiga severa.
- Febre.
- Consciência prejudicada (incl. letargia, confusão, sonolência, colapso, delírio, coma e convulsões).
Alterações laboratoriais
- Hiponatremia (normalmente com aumento de sódio urinário).
- Hipercalemia.
- Sinais de depleção de volume (por exemplo, uréia e creatinina elevadas).
- Hipoglicemia.
- Linfocitose.
- Eosinofilia.
Quaisquer potenciais desencadeadores identificáveis (por exemplo, infecções, trauma) devem ser tratados sempre que possível. A administração de curto prazo de glicocorticoides parenterais nas doses recomendadas é segura; portanto, o tratamento deve ser iniciado mesmo que o diagnóstico de crise adrenal seja eventualmente descartado.
Referência:
- Felix Beuschlein, Tobias Else, Irina Bancos, Stefanie Hahner, Oksana Hamidi, Leonie van Hulsteijn, Eystein S Husebye, Niki Karavitaki, Alessandro Prete, Anand Vaidya, Christine Yedinak, Olaf M Dekkers, European Society of Endocrinology and Endocrine Society Joint Clinical Guideline: Diagnosis and therapy of glucocorticoid-induced adrenal insufficiency, European Journal of Endocrinology, Volume 190, Issue 5, May 2024, Pages G25–G51.